Анатомия желудка человека
Желудок расположен в верхней части ЖКТ, между пищеводом и двенадцатиперстной кишкой. Переваривание и перетирание пищи, поступающей из пищевода, обеспечивается благодаря мощному мышечному слою желудка. Растворение питательных веществ до более простых элементов, далее легко всасываемых в кишечнике, происходит с помощью соляной кислоты и пепсину, выделяемым из внутренней слизистой оболочки органа.
Анатомически желудок состоит из четырех частей:
- кардиальной, примыкающей к пищеводу
- пилорической – примыкающей к 12-перстной кишке
- антральной – между пилорической и кардиальной частью
- фундальной – вверху и слева от кардиальной части.
Аналогичную слизистую оболочку имеют и тело, и дно желудка.
Гистология желудка предполагает разделение органа на четыре слоя: слизистый, подслизистый, серозный и мышечный. Гистологическое исследование направлено на максимально раннее обнаружение опухолевого процесса в любом из отделов желудка.
Чаще всего патологические процессы развиваются в кардиальном отделе желудка (переход пищевода в желудок). Гистология помогает с точностью выявить наличие раковых клеток в этом отделе на самых ранних стадиях развития.
Классификация
Согласно гистологической классификации рака желудка существуют следующие виды заболевания:
- аденокарцинома желудка (аденокарцинома желудка)
- муцинозная аденокарцинома
- тубулярная аденокарцинома
- папиллярная аденокарцинома
- воспалительная миофибробластическая опухоль желудка
- перстневидноклеточный рак желудка (перстневидный рак желудка)
- аденоплоскоклеточный рак
- недифференцированный рак желудка
- плоскоклеточный рак желудка
- мелкоклеточный рак желудка
- саркома желудка
- лимфома желудка
- карцинома желудка
- низкодифференцированный рак желудка.
Самая агрессивная форма рака желудка из вышеперечисленных — перстневидный рак желудка.
Аденокарцинома желудка является наиболее распространенной формой рака желудка, которая происходит из клеток железистого эпителия. На ранних стадиях заболевание может протекать бессимптомно. По мере развития злокачественной опухоли аденокарцинома желудка проявляться болями в области эпигастрия, потерей аппетита, тошнотой, отрыжкой, потерей веса, слабостью, апатией.
Диагностика аденокарциномы желудка проводится с помощью следующих исследований: ЭГДС с биопсией, рентгенографии желудка, онкомаркеров. Единственный радикальный метод лечения аденокарциномы – хирургический. Проводится операция по удалению опухоли. Лучевую и химиотерапию назначают в качестве дополнительных методик либо при наличии у пациента противопоказаний к проведению хирургического лечения.
Аденокарцинома желудка, в свою очередь, подразделяется на следующие виды:
- язва-рак – новообразование блюдцевидной формы, имеющая изъязвление в центральной части;
- скирр желудка – при распространении патологического процесса на большую часть желудка и проникновении его внутрь стенки органа;
- псевдоявзенный рак – опухоль, длительное время проявляющаяся симптомами язвы желудка;
- полипоидный рак – опухолевое образование, имеющее четкие границы, визуально напоминает полип;
- тубулярная аденокарцинома – опухоль, которую составляют клетки цилиндрического или кубического эпителия;
- слизистая аденокарцинома – новообразование, состоящая из слизепродуцирующих (муцинозных) клеток.
Согласно гистологической классификации, в основе которой лежит степень дифференцировки злокачественных клеток, аденокарцинома имеет следующие формы:
- недифференцированная аденокарцинома;
- аденокарцинома желудка низкодифференцированная (низкодефферентная аденокарцинома желудка);
- умеренно дифференцированная аденокарцинома желудка;
- высокодифференцированная аденома желудка.
Одной из достаточно редко встречаемых форма рака желудка является нейроэндокринная опухоль желудка.
В зависимости от локализации патологического процесса известно несколько видов рака желудка, например:
- рак антрального отдела желудка;
- кардиоэзофагеальный рак желудка с переходом на пищевод;
- рак пищевода и желудка;
- подслизистый рак желудка и т.д.
Однако, несмотря на огромное количество разновидностей рака желудка, основной задачей врач-онколога Юсуповской больницы является точное определение стадии онкопатологии, благодаря чему подбирается наиболее эффективная тактика лечения больного: облучение, химиотерапия или хирургическое вмешательство, чаще всего с удалением лимфоузлов (учитывая лимфогенное распространение злокачественных клеток). Лимфодиссекция при раке желудка — превентивная мера, позволяющая предупредить развитие рецидивов заболевания в дальнейшем.
Стадии
Независимо от расположения любое новообразование имеет четыре стадии развития. Каждая стадия рака желудка отличается размерами опухоли, количеством пораженных лимфатических узлов, наличием или отсутствием вторичных очагов злокачественных клеток (метастазов), которые распространяются по организму через кровеносные или лимфатические сосуды.
Наиболее распространенной и информативной с точки зрения точной диагностики является классификация по системе ТНМ. Стадии рака желудка по ТНМ дифференцируются по глубине прорастания опухоли, распространенностью на лимфатические узлы и наличию/отсутствию метастазов.
В предложенной ниже клинической классификации рака желудка описаны не только четыре основные стадии, но и подстадии, позволяющие описать каждый опухолевый процесс более точно.
| Стадия | Характеристика новообразования | Изменения в регионарных (местных) лимфоузлах | Наличие отдаленных метастазов |
| 0 |
Преинвазивный рак – опухоль, для которой характерно отсутствие прорастания злокачественных клеток в собственную слизистую оболочку. Опухоль имеет малые размеры, какие-либо клинические проявления отсутствуют (протекает бессимптомно). Преинвазивный рак обнаруживается случайно при проведении рентгенологического или эндоскопического исследования желудка |
Отсутствие метастазов в регионарных лимфоузлах | Отсутствие метастазов в отдаленных тканях и органах |
| Первая стадия: I А |
На данной стадии происходит прорастание раковой опухоли в собственную слизистую оболочку желудка либо её мышечную пластинку. Опухоль характеризуется относительно небольшими размерами (в среднем, до двух сантиметров). |
Отсутствие регионарных метастазов |
Отсутствие отдаленных метастазов |
| Первая стадия: I В |
Отмечается прорастание опухоли не только в собственную слизистую, но и в мышечную оболочку. Размеры опухолевого образования, как правило, не превышают двух сантиметров. |
Раковыми клетками в отдельных случаях поражаются близлежащие лимфоузлы, расположенные по наружному и внутреннему краю желудка (внутренняя или внешняя кривизна), а также в зоне концевого отдела желудка, отделяющего орган от 12-перстной кишки (пилорус). Чаще всего наблюдается поражение одного или двух близлежащих лимфоузлов (визуально их размеры увеличены). |
Отсутствие отдаленных метастазов |
| Вторая стадия: II А |
Вторая стадия рака желудка характеризуется прорастанием раковой опухоли в слизистую или мышечную оболочку, иногда с поражением подсерозной оболочки. Размеры опухоли на данной стадии составляют от 3,5 до 4 см. |
Поражение нескольких регионарных лимфоузлов (от 1 до 6) |
Отсутствие отдаленных метастазов |
| Вторая стадия: II В |
Рак желудка (2 стадия В) характеризуется прорастанием злокачественной опухоли в слизистую или мышечную оболочку. Кроме того, опухолевое образование может прорастать в серозную оболочку желудка. Рак желудка 2 степени отличается небольшими размерами, как правило, 2-5 см. |
Поражаются три-семь регионарных лимфоузлов |
Отсутствие отдаленных метастазов |
| Третья стадия: III А |
Отмечается поражение, как минимум, слизистой и мышечной оболочки желудочной стенки. Зачастую прорастание опухоли обнаруживается в подсерозном и серозном слое. Опухоль достигает более внушительных размеров – от 5 до 6 см. |
Рак желудка (3 стадия А) проявляется поражением одного-семи и более лимфатических узлов. |
Отсутствие отдаленных метастазов |
| Третья стадия: III В |
Происходит поражение не только всех слоев желудка, но и соседних тканей. Размеры новообразования достигают от 7 до 10 см. |
Отмечается поражение 3-7 и более лимфоузлов. | Отсутствие отдаленных метастазов |
| Третья стадия: III C |
Новообразование чаще всего поражает соседние органы. Размеры опухоли могут варьироваться, но, как правило, достигают семь и более сантиметров. |
Диагностируется поражение семи и более регионарных лимфоузлов. | Отсутствие отдаленных метастазов |
| Четвертая стадия: Четвертая стадия: IV |
Собственно, рак желудка. 4 стадия данного заболевания характеризуется любыми размерами и локализацией. Основной отличительной чертой рака желудка 4 степени является наличие метастатических процессов в других тканях и органах и развитие в них вторичных злокачественных новообразований. |
Четвертая стадия рака желудка характеризуется поражением более семи лимфоузлов. |
Обнаружение отдаленных метастазов в серозной оболочке, покрывающей внутреннюю стенку брюшной полости и находящиеся в ней органы, по ходу левой и правой желудочной артерии, в лимфоузлах сальника и селезенки, в легких, печени, почках, сердце, костях, головном мозге и др. |
Прогноз выживаемости при раке желудка
Выживаемость при раке желудка тесно коррелирует с моментом его обнаружения. Так, если он был найден вскоре после появления, то шансы на выздоровление составляют более 70%, а пятилетняя выживаемость (то есть шансы выжить в течении 5 лет с момента диагностирования) отмечается у 80% пациентов. Однако, как видно из описаний стадий и симптомов первой стадии, обнаружить рак можно скорее случайно, когда обследованию подвергаются соседние органы или желудок на предмет язвы, гастрита.
Даже вторую стадию диагностируют крайне редко, так как она может протекать без очевидных клинических проявлений. Если все же его выявить удалось, то пятилетняя выживаемость гарантируется в 50% — 60% случаев.
Начиная с третьей стадии, прогноз становится неблагоприятным. Она диагностируется уже чаще, примерно в 15% случаев, но пятилетняя выживаемость не превышает 40%. Симптомы четвертой стадии уже ярко выражены, поэтому чаще всего онкология выявляется именно на этой стадии (около 85% случаев). Поскольку для данной стадии характерно распространение метастазов в отдаленные ткани, органы и лимфоузлы организма, то пятилетняя выживаемость составляет всего 3-5%. А сама болезнь прогрессирует чрезвычайно быстро. Таким образом, ответить на вопрос, сколько живут с раком желудка, можно только после того, как установлен максимально точный диагноз и определена стадия онкологического заболевания. Чем раньше он обнаружен, тем выше шансы не только продлить жизнь заболевшего, но и излечиться полностью.
Показания к обследованию на рак желудка
Регулярная диагностика онкологии желудка показана прежде всего людям, которые входят в группу риска по развитию злокачественной опухоли. Принадлежность к группе риска определяется по наличию у человека предраковых заболеваний желудка — тех состояний, которые в большинстве случаев перерождаются в рак. К ним относят:
- активную хеликобактерную инфекцию;
- хронический атрофический гастрит;
- язвенную болезнь желудка с формированием каллезной язвы, которая всегда открыта, имеет четкие границы;
- полипы слизистой желудка.
При таких заболеваниях обследование желудка следует проводить ежегодно.
Изначально здоровым людям следует сдать анализы на рак желудка при появлении следующих симптомов:
- немотивированная нарастающая утомляемость, слабость;
- бледность кожи;
- изменение вкусовых предпочтений, ухудшение аппетита;
- потеря массы тела;
- постоянные боли в области пупка, левом подреберье;
- быстрое чувство насыщения при съедании малого объема пищи.
Большинство этих симптомов указывают уже на крупную опухоль, проросшую по меньшей мере кровеносные сосуды. На ранних стадиях, когда лечение наиболее эффективно, рак желудка ведет себя скрытно и не дает симптомов. Поэтому даже здоровым людям старше 40 лет рекомендовано раз в два года делать диагностическую фиброгастроскопию.
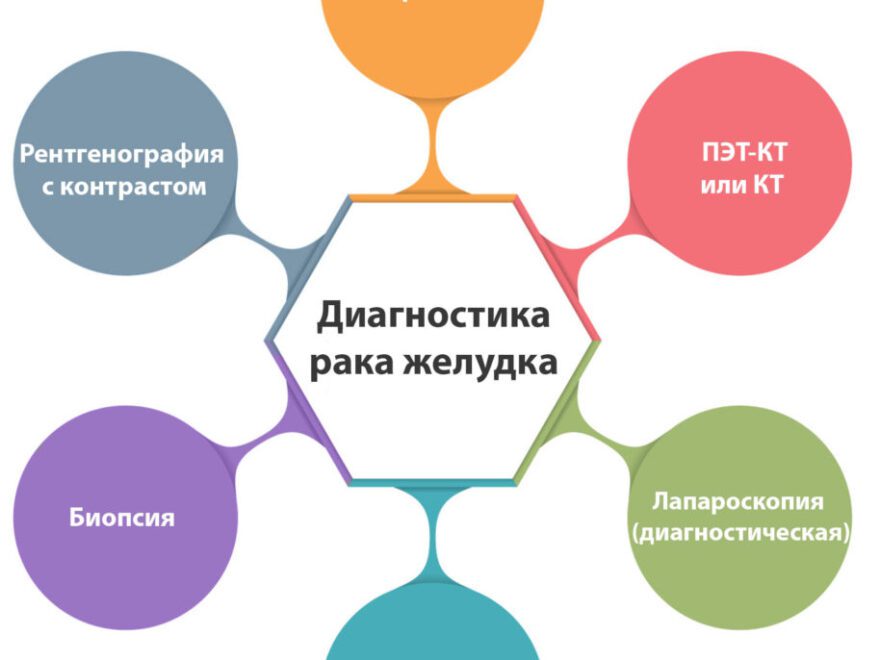
Методы диагностики рака желудка
Диагностика рака желудка включает лабораторные и инструментальные методы исследования. Первичная диагностика направлена на обнаружение злокачественного процесса в организме и расположение опухоли. Уточняющая диагностика определяет тип рака и его распространенность.
Основания для проведения диагностики
Диагностировать рак желудка довольно сложно, так как он «маскируется» под другие заболевания.
К общей симптоматике можно отнести такие признаки:
- дискомфорт в животе;
- вздутие (метеоризм) живота;
- снижение аппетита, с сопровождающейся потерей веса;
- тошнота;
- повышенное слюноотделение.

При дискомфорте в животе лучше всего провести диагностику желудка
Возможно также ощущение тяжести в животе и сопровождение его гнилостной отрыжкой. Частым спутником патологического процесса является изжога.
Основанием к проведению обследования являются вышеприведенные симптомы.
Лабораторная диагностика рака желудка
Исследование крови показано всем пациентам с подозрением на онкологическое заболевание:
- общий анализ крови покажет анемию, резкое увеличение СОЭ;
- биохимический анализ крови на ранних стадиях не информативен, при распространении опухоли на печень покажет увеличение трансаминаз АЛТ и АСТ;
- коагулограмма определяет нарушения свертываемости крови, которые также возникают уже на поздних стадиях болезни;
- анализ крови на онкомаркеры РЭА, СА 19-9, СА 72-4.
К лабораторным методам также относят исследование кала на скрытую кровь, кислотности желудочного сока. При некоторых формах рака кислотность сока повышается. Скрытая кровь в кале появляется, когда опухоль прорастает кровеносные сосуды.
В целом лабораторная диагностика рака желудка лишь косвенно указывает на диагноз, поскольку выявляет только результаты влияния опухоли на организм.
Анализ кала на скрытую кровь
Благодаря данному анализу распознается внутреннее кровотечение в пищеварительном тракте. Перед проведением данного обследования обязательно проводят подготовку. Врач прописывает специальную диету.
Также отбор пробы производят не только из начальной части, также нужно взять из общей массы. Количество не менее грецкого ореха. Сбор производят в специальный стерильный контейнер.
Он должен попасть в лабораторию в течение 3 часов.
Женщинам не стоит проводить анализ в дни менструации. Также нельзя использовать различные вспомогательные средства в виде свечей, клизм и прочего.
Нудно учитывать, что в норме у человека может выделяться с калом не более 1-2 г крови. Если этот показатель превышен, то можно говорить о присутствии кровотечения. Количество крови означает его массивность и местонахождение.
Может получиться как ложноположительный, так и ложноотрицательный результат. Каждый из них связан с различными факторами.
Исследование рвотных масс на скрытую кровь
Часты рвотные позывы в основном свидетельствуют о более глубокой стадии раковой опухоли.
При анализе полученный материал оценивают по следующим критериям:
Диагностику рака желудка проводят при помощи исследования рвотных масс
Цвет может говорить о степени заболевания и его распространения. Если в рвоте явно наблюдается кровь, это может говорить о повреждении сосудов и попадании крови из них в желудок.
Если проводится определенная терапия, то такое обстоятельство может наблюдаться в следующих случаях:
- неоперабельная стадия опухоли;
- химиотерапия;
- лучевая терапия;
- опухолевая интоксикация;
- наличие сопутствующих заболеваний;
- кишечная непроходимость;
- аспираторная пневмония и проч.
Генетические исследования
Генетический анализ на рак желудка предназначен для выявления онкомаркеров. В развитии данного заболевания находят большое значение наследственной предрасположенности. При исследовании нашли изменения в генах MSH2, MLH1, CDH1, которые определят предрасположенность к данному заболеванию.
Показаниями к обследованию становятся:
- наличие рака органов пищеварительной системы в анамнезе у близких родственников;
- вирус Эпштейн-Барра;
- язвенная болезнь желудка;
- ожирение 2-3 степени;
- состояния с иммунодефицитом;
- атрофический гастрит;
- анемия пернициозного вида;
- аденоматозные полипы;
- оперативные вмешательства в полости желудка.
Отбор крови для анализа производится строго на голодный желудок, время после принятия пищи должно пройти не менее 8 часов.
Рак желудка – сложное заболевание, которое трудно поддается не только лечению, но и диагностированию. Для обнаружения данного заболевания требуется пройти полное обследование, которое покажет его наличие или отсутствие.
Также оно необходимо для правильно подобранной терапии, которая будет способствовать угнетению развития опухолевых клеток.
Если существует генетическая предрасположенность, то нужно сдавать раз в год анализы на онкомаркеры, биохимический анализ крови и проводить гастроскопию.
Гастроскопия
Обследование проводится под наркозом. Специалист попадает в желудок через ротовую полость с помощью эндоскопа с подсветкой, оснащенного видеокамерой. Опухоль диагностируется при гастроскопии, и при обнаружении пораженного участка можно провести биопсию.
Визуально рак желудка может выглядеть как бугристое или выпуклое образование, язва с неровными краями и неровным глубоким дном или как компактный сегмент оболочки с инфильтрацией стенки желудка.
Зондирование
Учитывая, что при данной патологии поражается желудок, нелишним будет провести такую процедуру, как фракционное зондирование желудка – алгоритм ее достаточно простой и не требует сложного оборудования.
Применяется методика при различных патологиях желудка. Благодаря ей удается изучить состав желудочного сока. В частности, при подозрении на рак интересуют такие показатели, как эритроциты, лейкоциты, слущенные клетки, атипичные клетки и так далее.
Дополнительной диагностикой является забор материала из желудка на исследование
Исследование на онкомаркеры
Диагностировать рак желудка без применения сложных и не всегда легко переносимых исследований, к сожалению, пока невозможно. Хотя распространённой практикой «диспансеризации» уже стало исследование онкомаркеров. К сожалению, этот метод трудно отнести к высокочувствительным (чувствительность этих тестов не превышает 50%). И все же повышение значений СА 72-4, РЭА, СА 19-9 служит сигналом к обязательному углубленному обследованию и исследованию увеличенного показателя в динамике.
Большее значение онкомаркеры имеют при оценке распространенности процесса и при возникновении рецидива заболевания после успешного лечения.
Дифференциальная диагностика
Выяснив, как узнать рак желудка, стоит отметить, что и другие патологии могут иметь схожую симптоматику. Даже на рентгене или УЗИ не всегда удается точно определить злокачественный процесс. Именно поэтому особо важное значение уделяется дифференциальной диагностике. Благодаря ей удается исключить иные заболевания со схожей клиникой.
Дифференциальный диагноз рака желудка, в первую очередь, должен выполняться в отношении язвы. Именно эта патология протекает с клиникой, ничем не отличающейся от злокачественного процесса.
Также следует исключить полипы, эрозивный и атрофический гастрит. Но особенно сложно различить злокачественный процесс и доброкачественный. Именно по этой причине при подозрении на рак назначается биопсия.
Благодаря ей удается изучить клетки, из которых состоит опухоль.
- Таким образом, можно сделать вывод, что постановка диагноза при подозрении на рак может занять длительное время, но только после получения результатов можно будет назначить лечение, которое гарантировано даст положительный эффект.
Лучевые методы диагностики рака желудка
Лучевая диагностика рака желудка информативна при инфильтративном росте опухоли, когда она растет внутри стенки органа. К методам лучевой диагностики относят рентгенографию, компьютерную и магнитно-резонансную томографию.
Рентгенографию желудка делают в прямой и косой проекциях, пациент при этом стоит и лежит. В качестве контраста человеку дают выпить раствор сульфата бария. Вещество обволакивает слизистую, и на снимке видны участки с дефектами. Рентгенография определяет:
- форму и тип роста опухоли;
- размер;
- степень уменьшения просвета желудка;
- подвижность желудка.
Методом компьютерной или магнитно-резонансной томографии исследуют брюшную и грудную полости, забрюшинное пространство с целью выявления метастазов в другие органы.
Рентген желудка
Метод рентгенографии позволяет получить “фотографию” непрозрачных объектов, затрудняющих прохождение рентгеновского излучения. Однако желудок — полый тонкостенный орган, что же покажет снимок? Ответ прост: рентген желудка проводится для выявления различной степени накопления рентген-контрастного вещества (как правило, используются относительно нейтральные соли бария) внутренней поверхностью здорового желудка и возможными новообразованиями на ней. Но скрининг рака желудка на основе этого метода имеет существенный недостаток — лучевую нагрузку на организм (т.к. выполняется не один, а серия снимков, показывающих динамику прохождения рентген-контраста по ЖКТ). Поэтому включение рентгенографии в скрининг рака желудка целесообразно лишь у пациентов в группе риска. Массово рентген желудка среди здорового населения проводится только в Японии, что объясняется повышенной статистикой заболеваемости раком желудка в этой стране.
Ультразвуковая диагностика
Ультразвуковое исследование показывает метастазирование опухоли в лимфатические узлы, другие органы. С помощью УЗИ исследуют органы брюшной полости, почки и надпочечники, шейно-надключичную зону.
Биопсия
Для определения формы рака в особых условиях проводится гистологическое исследование частей подозреваемого органа. Образцы тканей в лаборатории окрашиваются и проверяются под микроскопом.
Эндоскопическая диагностика
С точки зрения воздействия на организм потенциально более безопасным является визуальный осмотр внутренней поверхности желудка. К тому же он лишен такого недостатка, как зависимость видимости новообразования от выбранной проекции рентгеновских снимков органа.
Однако, при всем развитии технологий медицинской техники, препятствием становится “человеческий фактор” — рефлекторные и психологические причины, значительно усложняющие введение эндоскопического инструмента через рот в полость желудка. Обеспечить беспрепятственное обследование в большинстве случаев позволяет сочетание мягкой местной анестезии и седативных средств.
Видеоэндоскопическое обследование желудка может иметь различные названия, зависящие от целевой зоны обследования и от особенностей применяемой техники:
- гастроскопия
- гастродуоденоскопия
- фиброгастродуоденоскопия
- фиброэзофагогастродуоденоскопия (ФЭГДС)
- видеоэзофагогастродуоденоскопия (ВЭГДС)
Если гастроскопия выполняется в специализированном онкоцентре, использующем современное оборудование (например, в Онкологической клинике МИБС в Санкт-Петербурге), существует возможность выполнить в рамках одной процедуры биопсию подозрительных участков слизистой желудка или выявленных новообразований.
Эндоскопическое УЗИ желудка (ультрасонография)
Набирает популярность совмещенная эндоскопическая диагностика, во время которой проводится как визуальная гастроскопия, так и ультразвуковое исследование (УЗИ) желудка.
Отличие эндоскопического УЗИ (ЭндоУЗИ) от традиционного ультразвукового исследования в размещении датчика непосредственно на эндоскопе, т.е. изнутри желудка. Таким образом врач получает более полную картину состояния органа с разрешающей способностью в 1 мм.
ЭндоУЗИ позволяет исследовать не только внутреннюю поверхность желудка, но и все его слои, т.е. диагностировать рак желудка, если у пациента имеются подслизистые новообразования, не видимые с поверхности.
Минусом является большая толщина эхоэндоскопа, в сравнении с современными эндоскопами для ФЭГДС, что еще больше ограничивает применение эхоэндоскопии в программах скрининга рака желудка.
Как видно из приведенного выше описания возможностей современной диагностики, рак желудка довольно сложно выявить с помощью массового скрининга. Поэтому важно учесть индивидуальные факторы риска рака желудка, принимая решение о включении / не включении гастроскопии в персональную программу онкоскрининга. А если человек наблюдает у себя симптомы рака желудка, своевременно пройдя диагностику он может спасти свою жизнь.
Показания к ЭГДС под наркозом
Гастроскопия под наркозом уже давно вошла в клиническую практику и зарекомендовала себя как безопасная процедура. Ее выполняют у всех пациентов – если только нет противопоказаний и человек сам не изъявил желания провести исследование без седации.
Противопоказания к эндоскопии под наркозом
В данном случае к ограничениям, связанным с эндоскопическим исследованием желудка, добавляются противопоказания для наркоза:
- аллергические реакции, непереносимость препаратов для «медикаментозного сна»;
- беременность;
- состояние алкогольного или наркотическое опьянения;
- острые состояния, которые угрожают жизни пациента, например, инфаркт миокарда;
- нежелание самого пациента проводить наркоз.
Гистологическое исследование
Микроскопическое исследование образцов ткани, полученных при фиброгастроскопии. Врач-гистолог готовит срез кусочка ткани, фиксирует его на предметном стекле, а затем изучает под микроскопом. Гистология определяет:
- степень дифференцировки опухолевых клеток;
- вид атипичных клеток;
- глубину прорастания новообразования в стенку желудка.
Лапароскопическая диагностика
Единственный инвазивный метод диагностики рака желудка. В ходе лапароскопии хирург раскрывает брюшную полость, что дает следующую информацию:
- степень поражения желудка;
- распространение опухоли по брюшине;
- наличие метастазов в других органах, лимфоузлах;
- асцит.
Лапароскопия с точностью подтверждает или исключает диагноз рака желудка, дает информацию о распространенности злокачественного процесса.
Компьютерная томография
Диагностика проводится контрастно, помогает получить полифоническое изображение органа с разных ракурсов. При выполнении метода оцениваются размеры и расположение опухоли, выявляются метастазы.
Позитронная эмиссионная компьютерная томография
При проведении теста, в вену пациента вводят радиоактивный индикатор, который реагирует на рак желудка, накапливаясь в области образования опухоли. Метод даже диагностирует раннюю стадию новообразования, локализацию новообразования, обнаруживает метастазы.
Лапароскопия
Обследование проводится для выявления вторичных образований в брюшной полости и изменений лимфатических узлов. Осуществляется путем введения специальных инструментов с камерой через 2–3 небольших прокола в брюшной полости. Также метод позволяет взять биопсию для исследования.
Магнитно-резонансная томография
МРТ проводится на специальном аппарате. Пациенту следует выпить раствор контрастного вещества. Затем томограф делает серию снимков. Процедура занимает около получаса и позволяет узнать обо всех дефектах диагностируемого органа.
Получив результаты анализов и исследований, специалист подбирает эффективное лечение. Диагностика рака желудка — важный шаг на пути к успеху избавления от опасного заболевания. При ранней диагностике и правильно подобранном лечении злокачественный процесс можно остановить и качество жизни человека не пострадает.
Диагностика, обеспечивающая лечение рака желудка
Несмотря на большую важность этого раздела для тех, кто в поисках квалифицированной медицинской помощи пришел на страницу по запросу “Рак желудка”, объем текста о методах диагностики, призванных установить наличие, размеры, расположение и распространенность рака желудка, будет значительно меньшим, чем часть о скрининге.
Связано это не с меньшим количеством доступных методов, которыми можно диагностировать рак желудка, а с их универсальностью. Гастроскопия в любом из ее видов (и ФЭГДС, и рентген желудка, и ЭндоУЗИ) является точным источником достоверной информации, на основании которой онколог поставит диагноз “рак желудка”, а междисциплинарный консилиум специалистов — разработает максимально эффективную тактику лечения.
Но между двумя этими этапами необходимо провести верификацию диагноза, т.е. убедиться в том, что новообразование состоит из злокачественных клеток. Единственный способ — взять образец ткани подозрительной части желудка (биопсия) во время эндоскопической гастроскопии и провести морфологическое исследование.
Если биопсия подтвердила рак желудка, целесообразно проведение иммуногистохимического исследования (ИГХ), которое призвано выявить потенциальную уязвимость конкретной опухоли к одному из современных таргетных препаратов. Если иммуногистохимия дает положительный ответ, тактика лечения будет иной, в том числе возможно лечение рака желудка без операции.
СОВРЕМЕННЫЕ ТЕХНОЛОГИИ В СВОЕВРЕМЕННОМ ВЫЯВЛЕНИИ И ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ РАКА ЖЕЛУДКА
СОВРЕМЕННЫЕ ТЕХНОЛОГИИ В СВОЕВРЕМЕННОМ ВЫЯВЛЕНИИ И ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ РАКА ЖЕЛУДКА
MODERN TECHNOLOGIES IN EARLY DETECTION AND DIFFERENTIAL DIAGNOSTICS OF GASTRIC CANCER
Аннотация. Изучены диагностические возможности лазерной спектро- и видеофлюоресцентной эндоскопии, комплексного трансабдоминального ультразвукового исследования, динамической мультиспиральной компьютерной томографии с возможностью построения мультипланарных реформаций и виртуальной гастроскопии в первичной диагностике рака желудка. Установлено, что лазерная спектральная флюоресценция с препаратом Аласенс (5-аминолевулиновая кислота) является высокоинформативным методом диагностики и дифференциальной диагностики рака желудка. Чувствительность метода составляет 96%, специфичность — 78%. Отчетливая видеофлюоресценция отмечена у 91,3% больных раком желудка. Возможность выявления рака при помощи комплексного трансабдоминального ультразвукового исследования в пилороантральном отделе и нижней трети тела желудка составляет в целом 95,6%, достигая абсолютных значений при Т3 и Т4 стадиях рака желудка. Динамическая мультиспиральная компьютерная томография позволяет выявлять рак желудка в 97%, достигая абсолютных значений начиная с глубины инвазии Т2, локализация опухоли значения не имеет. Проведена сравнительная визуальная оценка качества виртуального изображения и традиционной эзофагогастродуоденоскопии. Исследование продемонстрировало достаточно высокий уровень виртуального изображения, не уступающего при внутрипросветном росте опухоли по своему качеству традиционному изображению. Показания к применению данной методики нуждаются в дальнейшем уточнении.
Введение Несмотря на наметившуюся за последние десятилетия тенденцию к снижению частоты рака желудка (РЖ) во многих странах мира, заболевание продолжает занимать лидирующие позиции в структуре онкологических заболеваний и является одной из наиболее частых причин смерти от злокачественных новообразований [1, 2]. Общеизвестно, что успех лечения больных РЖ зависит в первую очередь от своевременной диагностики заболевания (выявление опухоли или первичная диагностика). Основными методами, позволяющими выявить опухолевое поражение желудка и подтвердить диагноз, являются эзофагогастродуоденоскопия с биопсией и рентгенологическое исследование верхних отделов желудочнокишечного тракта, дополненное методикой двойного контрастирования. Достоинства методов общеизвестны и неоспоримы. В то же время хорошо известны и их недостатки — сложности в выявлении раннего РЖ, а также опухолей с эндофитным подслизистым характером роста. Относительно высокая частота как ложноотрицательных, так и ложноположительных результатов биопсии диктует необходимость выполнения повторных эндоскопических исследований и биопсий [3]. В настоящее время одним из перспективных методов ранней диагностики злокачественных опухолей, в т. ч. и РЖ, является метод флюоресцентной лазерной спектроскопии [4, 5]. Этот метод позволяет повысить эффективность стандартного эндоскопического исследования при раке; в силу высокой информативности он получил название «оптической биопсии». Различают аутофлюоресценцию, т. е. флюоресценцию эндогенных порфиринов, концентрация которых в опухолевых клетках выше, чем в клетках желудочного эпителия, а также вторичную флюоресценцию, т. е. флюоресценцию специальных экзогенных фотосенсибилизаторов, тропных к клеткам опухоли. Для каждой методики характерны свои недостатки: фотосенсибилизаторы накапливаются не только в опухоли, но и в коже и видимых слизистых, где задерживаются длительное время и при нарушении «светового режима» вызывают фотодерматиты. К недостаткам регистрации аутофлюоресценции относится прежде всего невысокий коэффициент контрастности, необходимость высокоточного дорогостоящего оборудования. Метод лазерной флюоресцентной спектроскопии получил новые возможности с разработкой 5-аминолевулиновой кислоты (5-АЛК), которая индуцирует в клетках опухоли синтез и накопление фотоактивного протопорфирина IХ. Результатом является интенсивная флюоресценция, которую можно регистрировать не только с помощью спектроанализаторов, но и с помощью специальных высокочувствительных флюоресцентных эндоскопов, что открывает большие перспективы для клинической практики. По мере появления новых технологий лучевой диагностики и совершенствования имеющихся (ультразвуковое исследование, эндоскопическая ультрасонография, компьютерная томография, магнитнорезонансная томография, позитронно-эмиссионная томография), активно оцениваются возможности этих методов в своевременной диагностике РЖ. [6, 7, 8]. В частности, в ряде исследований были продемонстрированы большие потенциальные возможности комплексного трансабдоминального ультразвукового исследования (УЗИ) с водной нагрузкой как метода первичной диагностики РЖ [6]. Компьютерную томографию традиционно рассматривают как метод вторичной диагностики РЖ и применяют прежде всего для выявления отдаленных метастазов. Однако проведенные в последнее время исследования свидетельствует о том, что результаты мультиспиральной компьютерной томографии (МСКТ) не уступают рентгенологическому и эндоскопическому методам в выявлении РЖ. Кроме того, МСКТ позволяет после предварительного растяжения полости желудка воздухом выполнить т. наз. виртуальную гастроскопию. Для динамической МСКТ с построением мультипланарных реформаций и виртуальной эндоскопии характерны более широкий угол обзора органа, отсутствие слепых зон, в отличие от традиционной эндоскопии [8, 10]. К недостаткам метода следует отнести большие затраты времени для построения мультипланарных и виртуальных изображений, отсутствие оттенков цвета на границе поражения, невозможность выполнить биопсию, лучевая нагрузка [8, 10]. Большинство работ, посвященных первичной диагностики РЖ с помощью МСКТ, носят в основном пилотный характер. Целью настоящего исследования явилось: изучить диагностические возможности лазерной спектро- и видеофлюоресцентной эндоскопии, комплексного трансабдоминального УЗИ, МСКТ с возможностью построения мультипланарных реформаций и виртуальной гастроскопии в первичной диагностике РЖ.
Материалы и методы Исследования проводили в Клинике факультетской хирургии им Н.Н. Бурденко на базе хирургических отделений, межклинического эндондоскопического, межклинического лучевого отделений Первого МГМУ им. И.М. Сеченова в период с 2003 по 2010 гг. Были проанализированы результаты спектральной лазерной флюоресцентной диагностики (ФД) у 72 пациентов: 37 пациентов со злокачественными и 35 — с доброкачественными заболеваниями. Регистрация видеофлюоресценции была осуществлена у 25 пациентов (у 23 — РЖ, у 2 — доброкачественные заболевания). Исследование проводили с использованием препарата Аласенс, созданного на основе 5аминолевулиновой кислоты (производство ГНЦ НИОПИК), которую больные принимали перорально, предварительно растворив в 200 мл воды (10–20 мгкг веса) за 1,5–2 ч. до исследования. Для регистрации флюоресценции использовали спектроанализатор ЛЭСА 01 (совместное производство Биоспек Россия и ЦЕНИ ИОФ РАН). Для регистрации видеофлюоресценции (рис. 2) применяли специальную насадку для стандартного эндоскопа, состоящую из высокочувствительной камеры (0,0003 Люкса), системы светофильтров и светодиодный лазер с длиной волны 630 нм и мощностью 1,5 Вт. Комплексное трасабдоминальное УЗИ было выполнено 87 пациентам РЖ, исследование проводили на аппаратах SIQUOIA (фирма ACUSON, США), работающих в режиме реального времени и снабженных конвексным датчиком с частотой 2,5–3,5 МГц и линейным датчиком с частотой 7–11 МГц. При проведении УЗИ использовали двухэтапную методику с водной нагрузкой, предложенную Н. Worlicek и соавт. (1989). Динамическая МСКТ была выполнена 90 пациентам РЖ и 10 с подозрением на РЖ. МСКТ выполняли на 320-срезовом томографе Toshiba с шириной детектора 16 см и возможностью объемного динамического сканирования, что позволило получать изображение всего желудка в динамическом режиме без перемещения стола. После выполнения нативной серии выбирали зону исследования 16 см по оси Z (захватывающую весь желудок) и на фоне введения контрастного препарата выполняли исследование. Постобработка включала в себя построение мультипланарных реформаций и динамических видеофайлов. При построении виртуальной гастроскопии (16 пациентов) предварительно желудок раздували воздухом через зонд или путем применения специальной «шипучей смеси», состоящей из лимонной кислоты и соды (4–6 г). В целях объективной оценки информативности методов, применяемых в диагностике РЖ и оценке его распространенности, было проведено сопоставление результатов диагностики с данными, полученными при операции и гистологическом исследовании препаратов желудка. Для оценки стадии рака желудка применяли международную классификацию по системе ТNМ (UICC 2002). Анализ клинических данных производился с помощью стандартных методов статистической обработки с использованием программного обеспечения Microsoft Excel, SPSS 14.0., MedCalс 5.0.
Результаты исследования
Лазерная спектральная и видеофлюоресцентная диагностика рака желудка Диагноз РЖ был установлен до проведения ФД только 18 пациентам. Впоследствии диагноз у них был подтвержден как данными исследования интенсивности флюоресценции — PPIX (коэффициент контрастности 2,118,6), так и данными гистологического исследования. Из 31 пациента с предварительным диагнозом «язвенная болезнь желудка» у 12 при проведении ФД была определена высокая интенсивность флюоресценции (коэффициент контрастности 2,1–9,6) в краях изъязвления (рис. 1).
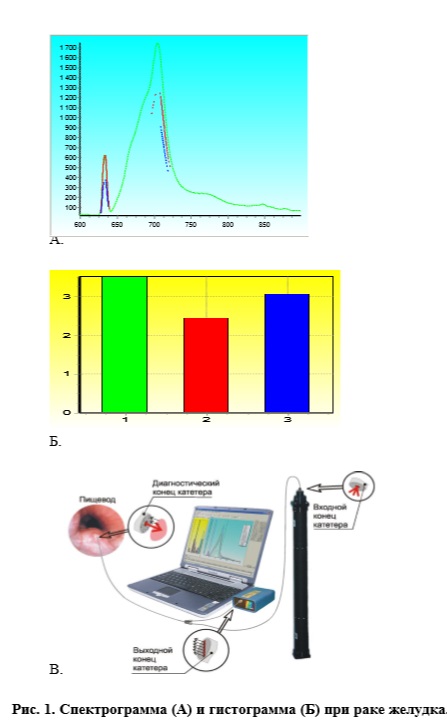
Была проведена прицельная биопсия слизистой в этих точках, при гистологическом исследовании взятого материала впоследствии подтвержден диагноз РЖ. У остальных 14 пациентов данные ФД (коэффициент контрастности 0,7–1,8) совпали с данными гистологического исследования, диагноз «язвенная болезнь желудка» был подтвержден. У 5 пациентов при эндоскопии обнаружены т. наз. атипичные, подозрительные на рак участки слизистой. При проведении ФД у четырех пациентов была выявлена высокая интенсивность флюоресценции АЛАиндуцироаанного PPIX (коэффициент контрастности 2,1–8) и так же проведена прицельная биопсия слизистой желудка, установлен диагноз РЖ. Аналогично у больного с полипом желудка (коэффициент контрастности 3,3) был обнаружен по результатам гистологического исследования рак in situ. У четырех пациентов с предварительным диагнозом «рак желудка» после проведения спектроскопии диагноз был отвергнут, что подтверждено данными последующего морфологического исследования. В 5 наблюдениях в 1–2 точках исследуемого участка визуально неизмененной слизистой желудка определялась высокая интенсивность флюоресценции АЛА-индуцированного PPIX. По результатам гистологического исследования у четырех из этих пяти пациентов была обнаружена выраженная воспалительная реакция. О том, что при воспалении может быть повышена генерация АЛА-индуцированного PРIX, сообщают многие зарубежные авторы [4]. Учитывая все сказанное, эти пациенты могут быть отнесены не к ложноположительным результатам, а к группе риска развития РЖ. Пациентам этой группы требуется профилактическое эндоскопическое исследование не реже одного раза в год. В одном наблюдении при ФД коэффициент контрастности составил 1,1, однако морфологическое исследование выявило высокодифференцированную аденокарциному. Этот результат можно отнести к ложноотрицательным. В целом коэффициент контрастности во всей группе больных РЖ составил 4,55+-0,2 (от 3,83-+0,6 при раке in situ до 6,13+-0,2 при IV стадии). У больных язвенной болезнью коэффициент контрастности составил -1,08+-0,7. Разница между значениями коэффициентов контрастности при злокачественных и доброкачественных заболеваниях статистически достоверна (р≤0,05). Чувствительность метода диагностики с исследованием Аласенс-индуцированной флюоресценции составила 96%, специфичность — 78%.
Видеофлюоресцентное исследование При проведении эндоскопического исследования флюоресцентных изображений желудка нами была отмечена отчетливая флюоресценция опухоли в 21 (в 91,3%) из 23 исследований больных РЖ (рис. 2).
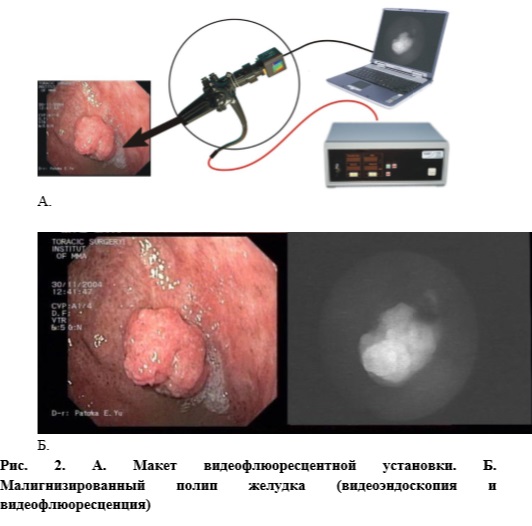
У двух больных при комплексном обследовании диагноз РЖ был исключен и, соответственно, видеофлюоресценция отсутствовала (ложноположительных результатов не зарегистрировано). Кроме того, была зарегистрирована флюоресценция очагов тяжелой дисплазии и малигнизации, что было подтверждено в последующем результатами анализа как спектров флюоресценции, так и данными биопсии.
Комплексное трансабдоминальное УЗИ в первичной диагностике РЖ
Для оценки возможностей комплексного трансабдоминального УЗИ как потенциального скринингового метода в выявлении РЖ нами были обследованы больные с различными стадиями опухолевого процесса и различной локализацией опухоли. Глубина инвазии Т1. Выявление заболевания на данной стадии развития патологического процесса является сложной задачей вследствие малой протяженности и глубины поражения органа (рис. 3).
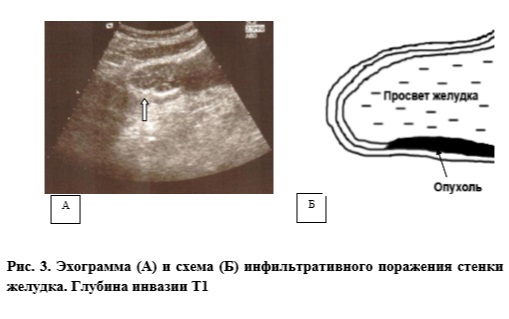
По результатам послеоперационного гистологического исследования глубина инвазии Т1 определена у 28 больных, выявить опухоль при проведении УЗИ удалось у 20 больных (у 8 при традиционном УЗИ и еще у 12 при УЗИ с водной нагрузкой). В шести наблюдениях опухоль локализовалась в зоне недоступной для УЗИ (кардия и верхняя треть тела желудка), в двух — в пилороантральной зоне и нижней трети тела у малой кривизны. В двух наблюдениях УЗИ было первым диагностическим мероприятием, которое позволило заподозрить ранний рак антрального отдела желудка в виде локального утолщения стенки желудка на протяжении 1,5 см, что в последующем и было подтверждено данными эндоскопии с биопсией и рентгенологического исследования. Таким образом, комплексное УЗИ позволило выявить опухоль при глубине инвазии Т1 в 72% наблюдений, а в случае локализации опухоли в пилороантральном отделе и нижней трети тела желудка этот уровень возрастал до 90%. Чувствительность и специфичность метода в определении глубины инвазии Т1 составила 42,9% и 91,8% соответственно.
Глубина инвазии Т2. По данным гистологического исследования, глубина инвазии Т2 отмечена у 19 больных, при комплексном УЗИ опухоль выявлена у 18 пациентов. У 1 больного опухоль локализовалась в области кардии и верхней трети тела желудка, т. е. зонах, недоступных для УЗИ исследования. На первом этапе комплексного УЗИ опухоль выявлена у 16 пациентов, еще у 2 — на втором этапе с водной пробой. Однако выявление опухоли с глубиной инвазии Т2 в ряде случаев являлось не простой задачей и было возможным лишь при тщательном методическом исследовании органа. Таким образом, при глубине инвазии Т2 удалось выявить опухоль в 95% случаев при локализации последней в пилороантральном отделе и теле желудка. Чувствительность и специфичность в определении глубины инвазии Т2 составила 63,2% и 81% соответственно.
Глубина инвазии ТЗ. По данным гистологического исследования, глубина инвазии Т3 отмечена у 16 пациентов. Во всех наблюдениях, кроме одного (небольшая по протяженности опухоль верхней трети и кардиального отдела желудка), нам достаточно легко удалось выявить опухоль как при стандартном УЗИ, так и при УЗИ с водной нагрузкой. Чаще всего при данной глубине инвазии на УЗ-изображении наблюдали наличие классического симптома «полого органа». При данной стадии заболевания имеется не только значительное утолщение стенки желудка, но и, как правило, протяженное распространение опухоли по длиннику органа, захватывающее несколько анатомических областей. Все это облегчало задачу выявления опухоли.
Таким образом, УЗИ с водной нагрузкой не повышало информативность в плане выявления опухоли при данной стадии заболевания, однако позволяло более четко оценить протяженность опухолевой инфильтрации, определить глубину опухолевой инвазии и дополнительно улучшить осмотр органов забрюшинного пространства. Комплексное трансабдоминальное УЗИ позволило выявить опухоль в 94% случаев при глубине инвазии Т3, при локализации опухоли в пилороантральной зоне и теле желудка выявляемость была абсолютной. Чувствительность и специфичность в отношении определения глубины инвазии составила 75% и 83,6% соответственно.
Глубина инвазии Т4. По данным гистологического исследования, глубина инвазии Т4 была отмечена у 14 больных. Во всех наблюдениях больных с глубиной инвазии Т4 как при стандартном УЗИ, так и при УЗИ с водной нагрузкой, удавалось легко выявить опухоль в виде симптома «полого органа», что было обусловлено обширностью поражения. В нашем исследовании у 4 больных при УЗИ было заподозрено прорастание в окружающие органы, магистральные сосуды и клетчатку, что в дальнейшем было подтверждено при интраоперационном УЗИ и ревизии органов брюшной полости. Таким образом, способность выявить опухолевое поражение желудка при данной глубине инвазии была абсолютной. Что касается вопроса чувствительности и специфичности метода, то они составили 85,7% и 93,7% соответственно.
Динамическая МСКТ в диагностике рака желудка
До недавнего времени КТ рассматривали лишь как метод вторичной диагностики РЖ. Поскольку динамическое МСКТ является более информативным диагностическим методом, нами были исследованы возможности первичной диагностики РЖ, в т. ч. при помощи т. наз. виртуальной эндоскопии.
Глубина инвазии Т1. На основании данных послеоперационного гистологического исследования глубина инвазии Т1 была диагностирована у 9 пациентов. Выявить опухоль удалось в 7 из 9 наблюдений (78%). Во всех выявленных случаях глубина инвазии Т1 характеризовалась неравномерным контрастированием слизисто-подслизистого слоя и нарушением перистальтики (даже при незначительном утолщении стенки). В двух наблюдениях раннего РЖ (карцинома in situ) опухоль выявить не удалось. Таким образом, чувствительность МСКТ в выявлении глубины инвазии Т1 составила 22%, специфичность — 100%, положительная предсказательная ценность (ППЦ) — 100%, отрицательная предсказательная ценность (ОПЦ) — 93%.
Глубина инвазии Т2. По результатам гистологического исследования, глубина инвазии была установлена у 13 больных. Выявить опухоль удалось во всех случаях, вне зависимости от локализации опухолевого процесса в желудке. Наиболее характерным КТ-симптомом при глубине инвазии Т2 (также как при Т1) является ограниченное утолщение стенки желудка (13,6±5,4 мм) с повышенным накоплением контрастного препарата и с нарушением перистальтики в этом отделе без вовлечения парагастральной клетчатки. Чувствительность МСКТ в выявлении глубины инвазии Т2 составила 69%, специфичность — 92%, ППЦ — 57%, ОПЦ — 95%.
Глубина инвазии Т3. В группу больных с глубиной инвазии Т3 по результатам гистологического исследования вошли 24 пациента. При глубине инвазии Т3 отмечается наличие выраженного (19±8,4 мм) утолщения стенки органа, неровность наружного контура с сетчатым или линейным уплотнением окружающей клетчатки. Накопление контрастного вещества опухолью имело различный характер и в большей степени зависело от гистологического варианта опухоли. Выявить опухолевое поражение на этой стадии процесса ввиду его распространенности не представляло сложности по сравнению со стадией Т2, а тем более Т1. Кроме того, при данной стадии заболевания имеется не только значительное утолщение стенки желудка, но и, как правило, более протяженное распространение опухоли, захватывающее несколько анатомических областей желудка, что особенно хорошо прослеживалось при построении мультипланарных изображений. Чувствительность МСКТ в выявлении глубины инвазии Т3 составила 80%, специфичность — 85%, ППЦ — 71%, ОПЦ — 91%.
Глубина инвазии Т4. Следует отметить, что при глубине инвазии Т4 отмечается наиболее значительное по глубине и протяженности поражение органа и во всех наблюдениях (36 пациентов), так же как при глубине инвазии Т3, не представляло сложности выявить опухоль. КТ-картина при глубине инвазии Т4 характеризовалась выраженным утолщением стенок органа (21,3±7,1 мм) с их нечетким контуром, инфильтрацией окружающей клетчатки, отсутствием границы между стенкой желудка и близлежащими органами и инвазией опухоли в окружающие органы (рис. 4).
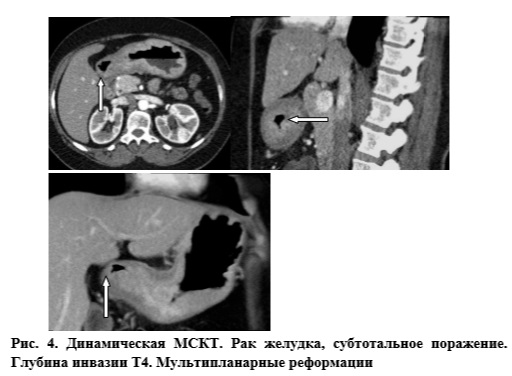
Достоверным критерием, подтверждающим наличие данной стадии заболевания, являлось выявление прорастания опухоли в окружающие органы и ткани. Так, по данным нашего исследования, у 18 больных при МСКТ было заподозрено прорастание рака желудка в рядом расположенные органы и магистральные сосуды, что в дальнейшем было подтверждено при интраоперационном УЗИ и ревизии органов брюшной полости. Чувствительность МСКТ в выявлении глубины инвазии Т4 составила 83%, специфичность — 95%, ППЦ — 91%, ОПЦ — 91%. В целом чувствительность МСКТ в выявлении рака желудка составила 97%, специфичность — 100%, ППЦ — 100%, ОПЦ — 77%.
Виртуальная эндоскопия
Некоторые авторы рассматривают виртуальную эндоскопию как потенциально скрининговый метод диагностики и дифференциальной диагностики РЖ. В этой связи мы провели оценку диагностических возможностей метода, а также качества полученного в процессе моделирования изображения. Лейомиома желудка. У двух пациентов по данным ЭГДС и рентгенологического исследования наблюдался внутрипросветный рост опухоли, у одной пациентки опухоль располагалась экстрагастрально, лишь незначительно вдаваясь в просвет органа. Во всех случаях виртуальное изображение, полученное в результате КТ моделирования, характеризовалось высоким качеством изображения, максимально приближаясь к изображению, полученному при видеоэндоскопии. Исследование позволяло уточнить локализацию опухоли, а плоскостные срезы демонстрировали расположение опухоли по отношению к стенке желудка (внутристеночное расположение с пролабированием в просвет, или экстрагастральное). Эти данные позволили заранее выбрать и спланировать оптимальную тактику лечения (всем больным выполнена клиновидная резекция желудка). При построении виртуального изображения у больных раком желудка следует отметить следующее. В тех случаях, когда отмечался экзофитный рост опухоли — 1 тип по R. Borrmann (отмечен в трех наблюдениях) (рис. 5), было получено наибольшее сходство виртуального изображения и видеоизображения (вне зависимости от локализации опухоли в желудке).
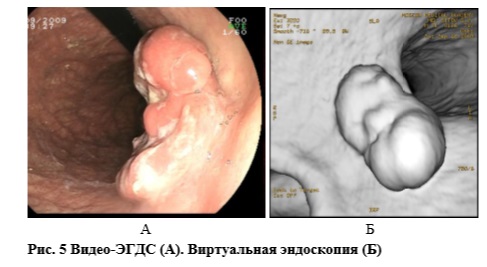
Высокое качество виртуального изображения отмечено также при инфильтративном и смешанном характере роста опухоли, а также при локализации последней в области тела желудка (5 пациентов). При инфильтративном росте опухоли с явлениями стенозирования выходного отдела желудка на качество полученного изображения влияло наличие жидкости (прежде всего ее количество) в просвете органа, что приводило к артефактам в процессе моделирования (отмечены у 2 из 5 больных). При этом слизистая в области поражения и близ нее характеризовалась чрезмерной зазубренностью. Хотя циркулярное сужение выходного отдела желудка, характерное для подобного поражения, было так же хорошо видно, как и при видеоэндоскопии. Виртуальное моделирование во всех случаях давало точную информацию по локализации опухолевого поражения, а также уточняло протяженность поражения по стенке органа. Плоскостные срезы уточняли глубину опухолевой инвазии, состояние регионарных лимфатических узлов, позволяли выявить отдаленные метастазы. Полученный в процессе исследования видеоряд, к сожалению, характеризовался монотонностью цветового изображения и не позволял выявить участки некроза и распада, кровоточивость поверхности опухоли, периопухолевые и воспалительные изменения слизистой. Высокий уровень (100%) выявления опухолевого поражения органа при проведении виртуального моделирования в нашем исследовании был обусловлен обширностью имевшегося у наших пациентов поражения (большие размеры лейомиом и распространенный рак желудка II–IV стадии), а также хорошим уровнем растяжения полости желудка.
Обсуждение результатов исследования
Несмотря на бурное развитие медицинских технологий, выявить и провести дифференциальный диагноз между доброкачественными и злокачественными изменениями в желудке бывает не просто. В связи с этим, разработка новых и совершенствование имеющихся технологий является важной задачей. Одним из наиболее перспективных методов повышения разрешающей способности эндоскопического исследования является лазерная спектро- и видеофлюоресценция. Процедура эндоскопической флюоресцентной диагностики лишь незначительно удлиняет время эндоскопического исследования (в отличие от хромоэндоскопии), а заключение о характере патологического процесса может быть сформулировано сразу в процессе проведения исследования. Комплекс аппаратуры, применяемой в настоящее время для проведения ФД, достаточно компактный (портативный) и мобильный, что позволяет осуществлять его доставку в эндоскопический кабинет. Дополнительных затрат времени для специального монтажа комплекса и подготовки его к работе в условиях кабинета не требуется. Быстрое выведение из организма Аласенса уменьшает вероятность развития токсических и световых реакций и делает его препаратом выбора для флюоресцентной диагностики. Изложенное выше позволяет рекомендовать метод лазерной спектральной ФД с исследованием Аласенс-индуцированного PPIX (а в перспективе и видеофлюоресценции) для использования в клинике как экспресс-метода диагностики (в т. ч. ранней диагностики) злокачественных заболеваний желудка. Проведенное исследование продемонстрировало, что комплексное трансабдоминальное УЗИ является высокоинформативным методом диагностики при РЖ. Возможность выявления РЖ при его локализации в пилороантральном отделе и нижней трети тела желудка при выполнении трансабдоминального УЗИ вне зависимости от критерия глубины инвазии Т приближается к абсолютной (97,4%). В то же время при изолированном поражении кардии и верхней трети тела желудка ни у одного из 10 обследованных нами больных выявить опухоль не удалось. В целом возможности выявить РЖ при всех локализациях опухоли методом комплексного трансабдоминального УЗИ составила 87,0%. Высокий уровень выявления опухолевого процесса в желудке в нашем исследовании был обусловлен тем, что у большинства пациентов мы точно знали локализацию процесса (по данным эндоскопии и рентгенографии желудка) и прицельно осматривали интересующую нас зону. Однако это нисколько не снижает возможность метода, а, наоборот, свидетельствует о его большом диагностическом потенциале. Ведь помимо впервые выявленных нами изменений в желудке (у 2 больных ранним РЖ), у целого ряда пациентов на поликлиническом этапе был выявлен «симптом полого органа», с последующим целенаправленным обследованием и подтверждением диагноза, после чего больные были направлены для оперативного лечения в клинику. Наш опыт доказывает, что при рутинном УЗИ органов брюшной полости нельзя ограничиваться исследованием только лишь паренхиматозных органов, а необходим прицельный осмотр и области полых органов (в частности, желудка), особенно у пациентов с явлениями абдоминального дискомфорта. Ведь у большинства подобных пациентов УЗИ является, как правило, первым, а подчас и единственным диагностическим мероприятием.
В исследованиях, выполненных в недавнем прошлом, отмечали невысокие диагностические возможности традиционного КТ-исследования в выявлении рака желудка, особенно при стадии Т1, когда не удавалось выявить изменений со стороны стенки желудка. В целом точность выявления глубины опухолевой инвазии при более распространенных формах оставалась тоже невысокой — не более 65% [11]. Главными ограничительными факторами являлись артефакты от перистальтических движений стенки желудка, что не позволяло оценить ее состояние при стандартном исследовании. Однако в настоящее время появление динамической объемной МСКТ с возможностью оценки стенки желудка во всех отделах в четырехмерном режиме значительно повысило диагностические возможности метода. В нашем исследовании динамическая объемная КТ оказалась высокоинформативным методом выявления рака желудка (чувствительность 97%). Такие высокие показатели были достигнуты, в первую очередь, благодаря появившейся при данной методике возможности оценивать нарушения перистальтики желудка, в отличие от традиционной КТ, ориентированной на определение лишь утолщения стенки органа. Динамическая МСКТ позволила в нашем исследовании выявить 7 из 9 (78%) ранних раков желудка прежде всего за счет характерного контрастирования слизисто-подслизистого слоя и нарушения перистальтики, при этом утолщения стенки практически не было. Справедливости ради надо отметить, что в настоящее время информативность МСКТ при раннем раке желудка уступает традиционному эндоскопическому исследованию. Прогресс в компьютерной технике привел к тому, что виртуальное моделирование все шире применяется в самых различных областях хирургии и онкологии [7]. Проведенное нами исследование продемонстрировало возможности подобного моделирования применительно к построению виртуальной гастроскопии. Получено высокое качество виртуального изображения, не уступающего в случае внутрипросветного характера роста новообразования традиционной видеоэндоскопии [8, 10]. Как следует из литературных данных, виртуальная эндоскопия не уступает по своим диагностическим возможностям традиционной эндоскопии в выявлении опухоли и оказывается информативнее, чем плоскостные срезы, особенно при небольшой глубине инвазии (Т2 и особенно Т1). Тем не менее справедливости ради следует отметить, что в настоящее время виртуальную эндоскопию нельзя рассматривать как реальную альтернативу традиционной видеоэндоскопии в качестве метода первичной диагностики рака желудка. Возможности широкого применения комплекса КТ-методик для дифференциальной диагностики доброкачественных и малигнизированных язв при отрицательных результатах биопсии на настоящий момент тоже вызывают сомнение, хотя первые сообщения на эту тему являются весьма обнадеживающими [12]. На наш взгляд, более оправданным для этих целей является использование эндо-УЗИ и лазерной флюоресцентной спектроскопии (т. наз. оптической биопсии). Виртуальное моделирование расширяет возможности метода, позволяет точнее выбрать зону для более пристального изучения стенки желудка с целью уточнения глубины опухолевой инвазии. Однако быстрый прогресс компьютерной техники и программного обеспечения, возможно, позволит в будущем рассматривать комплекс КТ-исследований, в т. ч. в режиме виртуальной эндоскопии, в качестве скринингового в странах с высоким уровнем заболеваемости [8, 10]. В настоящее время МСКТ находит широкое применение при самых разнообразных заболеваниях органов брюшной полости, забрюшинного пространства, позвоночника. Поэтому, на наш взгляд, представляется интересным и перспективным использование подобной методики для дополнительного исследования желудка — не только в группе повышенного риска развития РЖ, но и при проведении КТ-исследования органов брюшной полости по поводу других заболеваний с целью выявления изменений.
Выводы
1. Флюоресцентная диагностика с исследованием Аласенс-индуцированного протопорфирина IX является высокоэффективным, простым, безопасным методом диагностики РЖ. В диагностически сложных случаях может стать стандартным этапом эндоскопического исследования. Чувствительность метода составляет 96%, специфичность — 98%. 2. Разработанный метод регистрации видеофлюоресценции с препаратом Аласенс является перспективным скрининговым методом у больных РЖ и при предраковых состояниях. 3. Трансабдоминальное УЗИ является потенциально скрининговым методом при дистальной локализации РЖ. Возможность выявления рака желудка при его локализации в пилороантральном отделе и нижней трети тела желудка при помощи комплексного УЗИ составила 95,6%, достигая абсолютных значений в группах с Т3 и Т4. 4. Динамическая МСКТ является высокоинформативным методом выявления РЖ. Возможность выявления РЖ не зависила от локализации опухоли, и составила 97% во всей группе больных, достигая абсолютных значений, начиная с глубины инвазии Т2. 5. Показания к применению виртуальной эндоскопии как одного из режимов МСКТ в качестве метода первичной диагностики рака желудка и для скрининга заболевания нуждаются в дальнейшем изучении и уточнении. 6. Современные УЗ и КТ технологии позволяют не только проводить стадирование РЖ, но и осуществлять первичную диагностику заболевания. Однако техническая сложность и дороговизна КТ, невозможность выявления рака проксимального отдела желудка при УЗИ не позволяют в настоящее время рассматривать их в полной мере как скрининговые методы. Лазерная спектроскопия показана в диагностических сложных случаях, а видеофлюоресцентная диагностика нуждается в повышении разрешающей способности, после чего в полной мере может соответствовать статусу скринингового метода.
Список литературы
1. Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2004 г. // Вестник РОНЦ им. Н.Н. Блохина РАМН. — 2006. — Т. 17. — № 3. — С. 45–46. 2. Давыдов М.И., Аксель Е.М. Смертность населения России и стран СНГ от злокачественных новообразований в 2004 г. // Вестник РОНЦ им. Н.Н. Блохина РАМН. — 2006. — Т. 17. — № 3. — С. 78. 3. Портной Л.М. Современная лучевая диагностика в гастроэнтерологии и гастроэнтероонкологии. — М.: Видар-М, 2003. — 218 с. 4 Полсачев В.И. Дооперационная флюоресцентная диагностика распространенности рака желудка // Вестник хирургии. — 1989. — № 12. — С. 17–19. 5. Полсачев В.И. Флюоресцентный метод в дифференциальной диагностике доброкачественных и злокачественных заболеваний желудка // Вестник хирургии. — 1992. — № 1. — С. 95–97. 6. Горовая Н.С. Роль комплексного ультразвукового исследования в хирургическом лечении больных раком желудка. Автореф. … канд. мед. наук. — М., 2009. 7. Федоров В.Д., Карамазовский Г.Г., Гузеева Е.Б. и др. Виртуальное хирургическое моделирование на основе данных компьютерной томографии. — М.: Видар-М, 2003. — 184 с. 8. Kim J.H., Eun H.W., Choi J.H. et al. Diagnostic performance of virtual gastroscopy using MDCT in early gastric cancer compared with 2D axial CT: focusing on interobserver variation // Am. J. Roentgenol. — 2007. — Vol. 189. — P. 299–305. 9. Chen F., Ni Y.C., Zheng K.E. et al. Spiral CT in gastric carcinoma: comparison with barium study, fiberoptic gastroscopy and histopathology // World J. Gastroenterol. — 2003. — Vol. 9(7). — P. 1404–1408. 10. Kim J.H., Eun H.W., Hong S.S. et al. Early gastric cancer: virtual gastroscopy // Abdom. Imaging. — 2006. — Vol. 31(5). — P. 507–513. 11. Cidon E., Cuenca I. Gastric adenocarcinoma: is computed tomography useful in preoperative staging? // Clin. Med.: Oncology. — 2009. — Vol. 3. — P. 91–97. 12. Chen C.Y., Wu D.C., Kuo Y.T. et al. MDCT for differentiation of category T1 and T2 malignant lesions from benign gastric ulcers // Am. J. Roentgenol. — 2008. — Vol. 190(6). — P. 1505–1511.
Дифференциальный диагноз
Дифференциальный диагноз:
|
Диагноз |
Обоснование для дифференциальной диагностики |
Обследования |
Критерии исключения диагноза |
|
Язвенная болезнь |
Для исключения злокачественного характера язвы необходима множественная биопсия по краям дефекта и из дна язвы. |
обязательно выполняют ФЭГДС и |
Необходимо помнить о возможности заживления |
|
Полипы желудка |
Для исключения злокачественного характера полипов необходима биопсия. |
Размер полипов варьирует от небольшого выбухания до крупных полипоидных масс, имитирующих рак желудка. |
Полипы, как правило, бывают случайной |
|
Лимфома желудка |
Часто связана с инфекцией Helicobacter pylori. |
Характерны |
Для верификациии типирования необходима глубокая биопсия с иммуно- гистохимическим исследованием, наиболее часто речь идѐт о В-клеточной лимфоме. |
|
Саркома желудка |
Наиболее часто представлена лейомиосаркомой, занимающей переднюю или заднюю стенку желудка. |
Для верификации и типирования |
Характеризуется медленным ростом, |
Какой прогноз при раке желудка?
Прогноз при раке желудка зависит от стадии опухоли, на которой был установлен диагноз и начато лечение. Шансы на стойкую ремиссию наиболее высоки, если опухоль не проросла за пределы слизистой оболочки и подслизистой основы. При метастазах прогноз, как правило, неблагоприятен.
В онкологии существует такой показатель, как пятилетняя выживаемость. Он показывает, какой процент больных остаются живы в течение 5-ти лет. Срок достаточно большой, в определенном смысле его можно приравнять к выздоровлению. Пятилетняя выживаемость при разных стадиях рака желудка составляет:
- I стадия — 57-71%;
- II стадия — 33-46%;
- III стадия — 9-20%;
- IV стадия — 4%.
Некоторые цифры и факты:
- Эксперты Всемирной организации здравоохранения (ВОЗ) утверждают, что ежегодно от рака желудка во всем мире погибают 754 000 людей.
- В XXI веке распространенность заболевания снижается, но в разных странах неодинаково. Так, на одного больного из Великобритании приходится двое из России и трое из Японии.
- По распространенности среди прочих онкозаболеваний рак желудка занимает пятое место, но среди причин смерти — третье.
- Одна из лидирующих стран по распространенности рака – Япония, во многом за счет характера питания.
Прикреплённые файлы
| 1. ( Рак_желудка_2022.pdf ) | читать/скачать файл |
[spoiler title=»Источники»]
- https://yusupovs.com/articles/oncology/rak-zheludka-simptomy-i-lechenie/
- https://www.russcpa.ru/patsientam/o-rake/rak-zheludka/
- https://oncology-spb.ru/zabolevaniya/organy-zhkt/rak-zheludka/diagnostika-raka-zheludka
- https://uzmodb.by/blog/bolezni-zheludka/rannyaya-diagnostika-raka-zheludka-osnovaniya-analizy-i-issledovaniya-metody.html
- https://www.krasbionika.ru/biblioteka/vidy-diagnostiki-raka-zheludka/
- https://www.euroonco.ru/oncology/onkologiya-zhkt/rak-zheludka/diagnostika-rak-zheludka
- https://radiosurgery.ldc.ru/stati/rak-zheludka-kakie-vidy-diagnostiki-luchshe
- https://sechenovclinic.ru/treatments/detail.php?SECTION_ID=&ELEMENT_ID=3679
- https://diseases.medelement.com/disease/%D1%80%D0%B0%D0%BA-%D0%B6%D0%B5%D0%BB%D1%83%D0%B4%D0%BA%D0%B0-%D0%BA%D0%BF-%D1%80%D0%BA-2022/17462
- https://www.euroonco.ru/oncology/onkologiya-zhkt/rak-zheludka
[/spoiler]